轉移性癌症的免疫療法
我們的興趣是開發能有效治療轉移性癌症的免疫療法,並研究其療效的機制。我們使用具有染色體不穩定性及自發轉移性的EO771 乳癌模型,研究自體自然殺手(NK)細胞療法、環磷酰胺 (CTX) 化療及其組合。
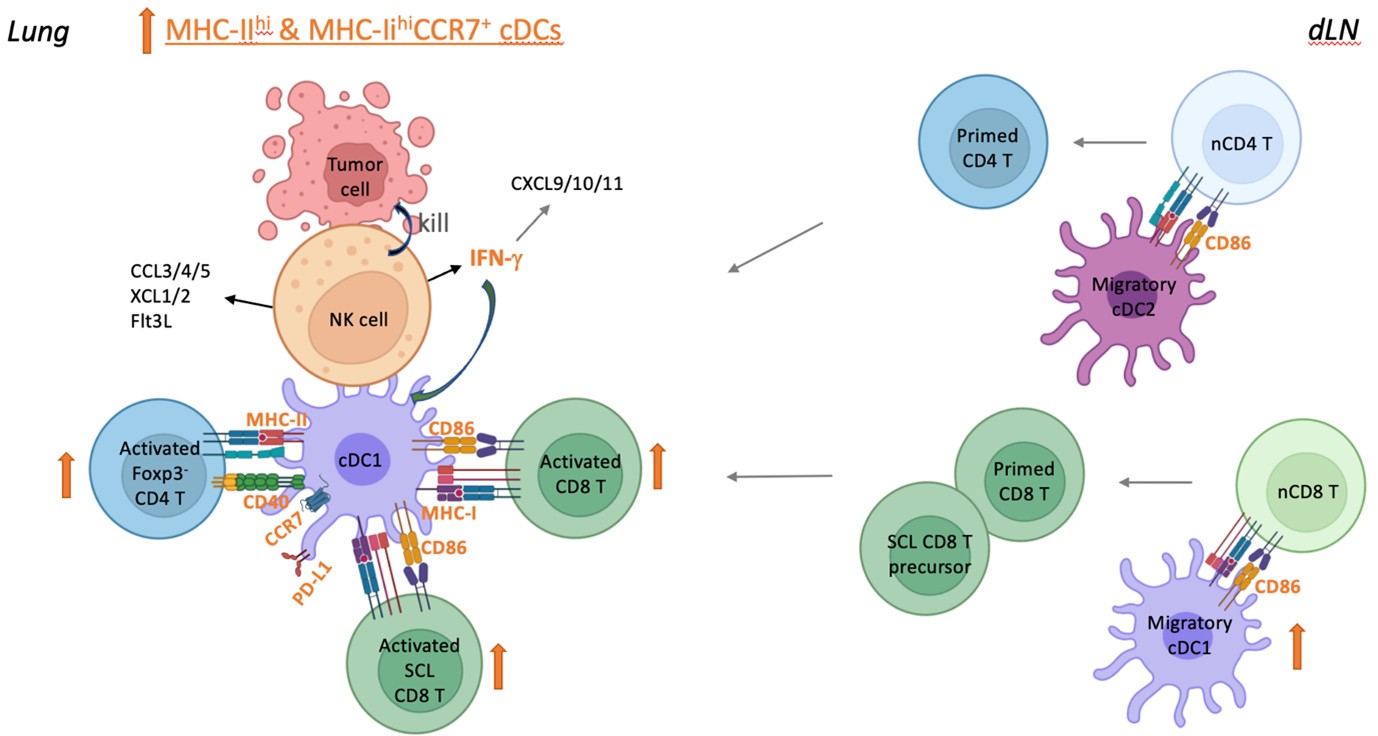
自體 NK 細胞療法透過活化轉移性肺部中的常規樹突細胞來增強抗腫瘤 T 細胞反應
我們用介白素 15 (IL-15) 和 IL-12 在體外培養NK 細胞,並在切除原發腫瘤和引流淋巴結 後將這些NK 細胞注射到已有肺轉移的小鼠體內,以模擬手術患者遠端部位的癌症復發。我們發現自體 NK 細胞療法可促進轉移負擔較低的腫瘤切除小鼠的長期生存,並誘導產生具保護性之腫瘤特異性 T 細胞記憶。此外,注射NK 細胞增強了轉移性肺部中的 1 型和 2 型常規樹突狀細胞 (cDC1 和 cDC2)、Foxp3-CD4+ T 細胞和類幹細胞 (SCL) CD8+ T 細胞的活化,而NK 細胞的 IFN-γ 對此有顯著貢獻。這些結果建議注射的 NK 細胞和體內 cDC 之間直接相互作用以增強 T 細胞活化。我們也對六名晚期癌症患者進行了由研究者發起的自體 NK 細胞療法臨床試驗,並觀察到 NK 細胞療法是安全的並且顯示出有效的跡象。這些結果指出自體 NK 細胞療法透過活化轉移部位的 cDC-T 細胞軸,可有效治療已建立的低負擔轉移癌症。
自體 NK 細胞療法增強轉移性肺腫瘤抗腫瘤 T 細胞反應的模型。 過繼轉移的自體 NK 細胞進入轉移性肺組織並直接與 cDC 相互作用,促進 cDC1 和 cDC 2 的活化以及隨後 CD4+ 和 CD8+ T 細胞的活化。肺組織中活化的 cDC 的增加可能導致 dLN 中遷移的 cDC 的增加,從而導致 dLN 中歸巢至肺組織的啟動 T 細胞的增加。轉移的 NK 細胞的 IFN-γ 對轉移性肺部中的 cDC 和 T 細胞的活化有顯著貢獻。
CTX 有效治療晚期乳癌需要宿主髓系細胞中的 GAS 和 STING
我們發現 CTX 療法可促進高負擔轉移性 EO771 乳癌小鼠的長期存活。鑑於CTX造成腫瘤細胞DNA損傷並增加全身第一型干擾素(IFN-I),我們研究宿主cGAS和STING在CTX體內抗腫瘤作用中的角色。我們發現 CTX 療法的有效性需要 CD8+ T 細胞和骨髓衍生細胞的 cGAS及STING。此外,cDC1 和 LysM+ 細胞的 STING 以及非 cDC1 髓系細胞的 IFN-I 反應對於 CTX 療效至關重要。我們也發現,在 CTX 治療下,骨髓衍生細胞的 cGAS 和 STING正向調節腫瘤內之Exhausted和 SCL CD8+ T 細胞群,而後者僅受 cGAS 的影響。我們的研究結果闡明了依賴 CD8+ T 細胞的CTX抗腫瘤機制關鍵涉及宿主髓系細胞中的 cGAS-STING-IFN-I 軸、IFN-I 反應和 STING-independent cGAS 功能。這些發現指出,在治療晚期實體瘤時可使用 CTX 來克服腫瘤細胞因應對染色體不穩定性引起的內在 cGAS-STING 的慢性活化而無法產生 IFN-I 的問題。
CTX 療法透過活化宿主髓系細胞中的 cGAS 和 STING 發揮 CD8+ T 細胞抗腫瘤作用的模型。 CTX 的活性代謝物透過 dsDNA 交聯誘導增殖腫瘤細胞的免疫原性死亡。從死亡腫瘤細胞中釋放的 dsDNA 有效地靶向 APC 並觸發 cGAS–STING–IFN-I 路徑。 cDC1 和巨噬細胞的 STING 以及某些 LysM+ 或/和 CD11c+ 非 cDC1 髓系細胞的 IFN-I 反應對於 CTX 療效至關重要。在CTX治療條件下,骨髓衍生細胞的cGAS和STING透過抑制CD8+ TEX細胞群水平和PD-1hiCD8+ T細胞的Lag-3和Tim-3來促進腫瘤中的CD8+ T細胞反應,而骨髓衍生細胞的cGAS在不依賴STING的狀況下維持CD8+TSCL細胞群水平。
我們也進一步發現,與單一療法相比,CTX 化療與自體 NK 細胞療法相結合可顯著提高治療高腫瘤負擔轉移性 EO771 乳癌的長期存活率。這些研究結果建議使用CTX及自體 NK 細胞組合療法治療晚期癌症的可能性。
- PDF, 1991, Dept. Mol. & Cell Biol. UC-Berkeley, USA
- PDF, 1987-1990, Ctr. Cancer Res. M.I.T., USA
- Ph.D., 1986, Dept. Biol. Sci. Illinois State Univ., USA
- BS, 1980, Dept. Nutri. & Food Sci. Fu-Jen Catholic Univ.
- Chu, C.-L., Chen, S.-S., Wu, T.-S., Kuo, S.-C., and Liao, N.-S. (1999) Differential effects of IL-2 and IL-15 on the death and survival of activated TCRγδ+ intestinal intraepithelial lymphocytes. J. Immunol. 162:1896, 10.4049/jimmunol.162.4.1896
- Lai, Y.-G., Gelfanova, V., Kulik, L., Chu, C.-L., Jeng, S.-W., and Liao, N.-S. (1999) IL-15 promotes survival but not effector function differentiation of CD8+ TCRαβ+ intestinal intraepithelial lymphocytes. J. Immunol. 163:5843, DOI: 10.4049/jimmunol.163.11.5843
- Lai, Y.-G., Hou, M.-S., Hsu, Y.-W., Chang, C.-L., Liou, Y.-H., Tsai, M.-H., Lee F., and Liao, N.-S. (2008) IL-15 does not affect IEL development in the thymus but regulates homeostasis of putative precursor and mature CD8aa+ IELs in the intestine. J. Immunol. 180: 3757, DOI: 10.4049/jimmunol.180.6.3757
- Lee, G.A., Wang, S.-W., Liou, Y.-H., Jiang, S.-T., Ko, K.-L. and Liao, N.-S.* (2011) Different NK cell developmental events require different levels of IL-15 trans-presentation. J. Immunol. 187:1212-21, DOI: 10.4049/jimmunol.1100331
- Chang, C.-L., Lai, Y.-G., Hou, M.-S., Huang, P.-L. and Liao, N.-S.* (2011) IL-15R expressed by radiation-resistant cells is necessary and sufficient for thymic iNKT cell survival and functional maturation. J. Immunol. 187:1235-42, doi: 10.4049/jimmunol.1100270
- Lai, Y.G., Hou, M.S., Lo, A., Huang, S.T., Huang, Y.W., Yang-Yen, H.F., Liao, N.S. (2013) IL-15 modulates the balance between Bcl-2 and Bim via Jak3/1- PI3K-Akt-ERK pathway to promote CD8αα+ intestinal intraepithelial lymphocyte survival. Eur. J. Immunol. 43: 2305, DOI: 10.1002/eji.201243026
- Liou, Y.H., Wang, S.W., Chang, C.L., Huang, P.L., Hou, M.S., Lai, Y.G., Lee, G.A., Jiang, S.T., Tsai, C.Y., Liao, N.S. (2014) Adipocyte IL-15 regulates local and systemic NK cell development. J. Immunol. 193: 1747, DOI: 10.4049/jimmunol.1400868.
- Hou, M.S., Huang, S.T., Tsai, M.H., Yen, C.C., Lai, Y.G., Liou, Y.H., Lin, C.K., Liao, N.S. (2015) The interleukin-15 system suppresses T cell-mediated autoimmunity by regulating negative selection and nT17 cell homeostasis in the thymus. J. Autoimmunity 56: 118, doi: 10.1016/j.jaut.2014.11.003.
- Huang, P.L., Hou, M.S., Wang, S.W., Chang, C.L., Liou, Y.H., Liao, N.S. (2015) Skeletal muscle interleukin 15 promotes CD8+ T-cell function and autoimmune myositis. Skeletal Muscle 5: 33, DOI: 10.1186/s13395-015-0058-2
- Lee, G.A., Lai, Y.G., Chen, R.J., Liao, N.S. (2017) Interleukin 15 activates Akt to protect astrocytes from oxygen glucose deprivation-induced cell death. Cytokine 92: 68, doi: 10.1016/j.cyto.2017.01.010.
- Lee, G.A., Lin, T.N., Chen, C.Y., Mau, S.Y., Huang, W.Z., Kao, Y.C., Ma, R.Y., Liao, N.S. (2018) Interleukin 15 blockade protects the brain from cerebral ischemiareperfusion injury. Brain Behav. Immnu. 73: 562, doi: 10.1016/j.bbi.2018.06.021.
- Lee, G.A., Chang, C.M., Wu, Y.C., Ma, R.Y., Chen, C.Y., Hsue, Y.T., Liao, N.S.*, Chang, H.H.* (2021) Chinese herbal medicine SS-1 inhibits T cell activation and abrogates TH responses in Sjögren’s syndrome. J. Formos. Med. Assoc. 120: 651, doi: 10.1016/j.jfma.2020.07.024.
- Huang SW, Lai YG, Liao HT, Chang CL, Ma RY, Chen YH, Liou YH, Wu ZQ, Wu YC, Liu KJ, Huang YT, Yang JL, Dai MS*, and Liao NS* (2025) Syngeneic natural killer cell therapy activates dendritic and T cells in metastatic lungs and effectively treat low-burden metastases. eLife DOI: 10.7554/eLife.99010.3
- Lai YG, Liao HT, Chen YH, Huang SW, Liou YH, Wu ZQ, and Liao NS (2025) cGAS and STING in host myeloid cells are essential for effective cyclophosphamide treatment of advanced breast cancer. Cancers 17:1130, DOI: 10.3390/cancers17071130